Эпилепсия
-
Оптогенитическая стимуляция для подавления эпилептической активности
На сегодняшний день до 30% пациентов с эпилепсией,к сожалению, резистентны к существующим фармакологическим методам лечения.Одной из потенциальных альтернатив, не имеющих подобных побочных явлений, является оптогенетическая стимуляция, при которой мембранные белки (микробные родопсины) активируются светом определенной длины волны. Ученые Института эволюционной физиологии и биохимии им. Сеченова и МФТИ использовали в качестве оптогенетического инструмента родопсин из морской флавобактерии Krokinobactereikastus (KR2), экспрессировав его в области мозга мышей. Результат работы опубликован в журнале Molecular Neurobiology. Об исследовании сообщает журнал «За науку» МФТИ.Trofimova, A.M., Amakhin, D.V., Postnikova, T.Y. et al. Light-Driven Sodium Pump as a Potential Tool for the Control of Seizures in Epilepsy. Mol Neurobiol (2023). https://doi.org/10.1007/s12035-023-03865-z -
Новая модификация карбамазепина
Ученые нашли способ повысить растворимость карбамазепина — препарата для лечения маниакально-депрессивного расстройства и эпилепсии.Для этого авторы измерили растворимость препарата в биологических жидкостях и оценили способность преодолевать естественные барьеры в организме человека. Карбамазепин плохо растворим, поэтому авторы добавили к нему поверхностно-активные вещества различного состава: полимерное соединение плюроник F127, способное образовывать пузырьки — мицеллы, и циклический полисахарид — циклодекстрин, образующий водорастворимый комплекс с молекулой лекарства.Результаты исследования опубликованы в журнале Pharmaceutics.Volkova, T.; Simonova, O.; Perlovich, G. Mechanistic Insight in Permeability through Different Membranes in the Presence of Pharmaceutical Excipients: A Case of Model Hydrophobic Carbamazepine. Pharmaceutics 2024, 16, 184. https://doi.org/10.3390/pharmaceutics16020184 -
Самоорганизованная бистабильность в глобально связанных сетях
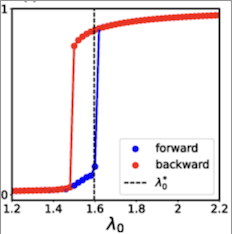 Ученые из России, Индии и Бельгии разработали математическую модель, описывающую состояние мозга при эпилепсии. Система воспроизводит изменение активности мозга во время припадка, а также учитывает множественные взаимодействия между нейронами и другими клетками мозга. Разработанная модель расширит представления о механизме развития эпилептического припадка, а также поможет в лечении заболевания. Результаты исследования опубликованы в журнале Physical Review.«В дальнейшем мы планируем улучшить нашу модель путем рассмотрения более реалистичных подходов к моделированию нервных клеток мозга. Также нас интересует вопрос рассмотрения наиболее точного взаимодействиями между различными клетками мозга для наилучшего понимания процессов в эпилептическом мозге. Вероятно, что наша модель может быть интересна для тестирования эффекта различных антиэпилептических препаратов на мозг», — рассказывает Александр Храмов, доктор физико-математических наук, главный научный сотрудник Балтийского центра нейротехнологий и искусственного интеллекта БФУ имени Иммануила Канта.Anwar, M. S., Frolov, N., Hramov, A. E., & Ghosh, D. (2024). Self-organized bistability on globally coupled higher-order networks. Physical Review E, 109(1), 014225. https://doi.org/10.1103/PhysRevE.109.014225
Ученые из России, Индии и Бельгии разработали математическую модель, описывающую состояние мозга при эпилепсии. Система воспроизводит изменение активности мозга во время припадка, а также учитывает множественные взаимодействия между нейронами и другими клетками мозга. Разработанная модель расширит представления о механизме развития эпилептического припадка, а также поможет в лечении заболевания. Результаты исследования опубликованы в журнале Physical Review.«В дальнейшем мы планируем улучшить нашу модель путем рассмотрения более реалистичных подходов к моделированию нервных клеток мозга. Также нас интересует вопрос рассмотрения наиболее точного взаимодействиями между различными клетками мозга для наилучшего понимания процессов в эпилептическом мозге. Вероятно, что наша модель может быть интересна для тестирования эффекта различных антиэпилептических препаратов на мозг», — рассказывает Александр Храмов, доктор физико-математических наук, главный научный сотрудник Балтийского центра нейротехнологий и искусственного интеллекта БФУ имени Иммануила Канта.Anwar, M. S., Frolov, N., Hramov, A. E., & Ghosh, D. (2024). Self-organized bistability on globally coupled higher-order networks. Physical Review E, 109(1), 014225. https://doi.org/10.1103/PhysRevE.109.014225 -
Повышение уровня малых внеклеточных везикул в крови пациентов с депрессией, эпилепсией и эпилепсии с депрессией

Недавно опубликованная совместная статья исследователей из ИВНДиНФ РАН и НПЦ психоневрологии поднимает новые вопросы в изучении малых внеклеточных везикул (мВВ) в крови человека. Ранее коллективом с помощью четырех разных методов было показано полуторакратное повышение концентрации мВВ в крови пациентов с депрессией по сравнению со здоровыми добровольцами, и следующая статья была призвана прояснить источник этих «дополнительных» везикул при депрессии. Кроме того, авторы взяли для сравнения несколько более широкий спектр патологий, включающий эпилепсию, эпилепсию с депрессией, биполярное аффективное расстройство с текущим депрессивным эпизодом и психогенные неэпилептические приступы на фоне депрессии. Малые ВВ выделяли из сыворотки крови пациентов с помощью гель-фильтрации или преципитации полиэтиленгликолем (ПЭГ), и оба метода показали очень похожие результаты. Оказалось, что у пациентов с депрессией, эпилепсией или эпилепсией с депрессией общий уровень мВВ в крови повышен в полтора-два раза по сравнению со здоровыми добровольцами. Авторам работы удалось пойти дальше и выделить фракцию мВВ нейронального происхождения (в крови это примерно каждая сто пятидесятая везикула) у этих пациентов, но, увы, разницы в концентрации нейрональных мВВ между какими бы то ни было группами обнаружено не было. Вопрос о том, откуда же взялись «лишние» мВВ крови пациентов, остался открытым. Авторы предполагают, что источником этих мВВ являются иммунные клетки. Тем не менее, по крайней мере одна новая находка, проливающая свет на биогенез мВВ, авторами все же обнаружена. Оказалось, что мВВ в сыворотке и пациентов, и здоровых добровольцев содержат различные лизосомальные ферменты – а это уже намек на то, что содержимое мВВ может отражать состояние внутриклеточной эндолизосомальной системы.
-
Адренергическая иннервация головного мозга играет ключевую роль в регуляции сна и эпилепсии.
В головном мозге человека и животных описаны два основных типа адренорецепторов (альфа и бета) и множество подтипов. Альфа2- адренорецепторы заслуживают особого внимания, поскольку они вовлечены в модуляцию сна и абсанс-эпилепсии. В 2023 году группа молодых учёных под руководством старшего наставника д.б.н. Е.Ю.Ситниковой начала исследования адренергических механизмов сна и эпилепсии, результаты которых были опубликованы в журналах International Journal of Molecular Science и Frontiers in Neurology [1, 2, 3]. Известно, что терапевтические дозы агонистов альфа2-адренорецепторов (например, дексмедетомидин) имеют седативный эффект и вызывают медикаментозный сон у человека и животных. Эти препараты в низких дозах вызывают генерализованную пик-волновую активность на электроэнцефалограмме, т.е. проявление абсансной эпилепсии, у крыс с генетической предрасположенностью к данной болезни (WAG/Rij) [1, 2, 3]. Так, однократная инъекция дексмедетомидина в дозе около 0.005 мг/кг усиливала абсанс-эпилепсию у крыс WAG/Rij (генетическая модель абсанс-эпилепсии) вплоть до наступления эпилептического статуса у особей с тяжелой абсанс-эпилепсией, [2], но не вызывали абсанс-эпилепсию de novo у бессимптомных крыс [1, 2]. Дексмедетомидин регулярно используется в клинической практике, и может быть использован в низких дозах для диагностики скрытых форм абсанс-эпилепсии [1]. Следует учитывать высокий риск провокации абсансного статуса при использовании агонистов альфа2-адренорецепторов у пациентов с абсанс-эпилепсией или при генетической предрасположенности к этому заболеванию [1].
На основании анализа собственных и литературных данных была выдвинута новая концепция таргетной фармакотерапии абсансной эпилепсии с помощью антагонистов альфа2В-адренорецепторов [1, 3].
- Sitnikova E.Adrenergic mechanisms of absence status epilepticusFront. Neurol. 2023 14: 1298310. DOI: 10.3389/fneur.2023.1298310
- Sitnikova E., Pupikina M.,Rutskova E.Alpha2 Adrenergic Modulation of Spike-Wave Epilepsy: Experimental Study of Pro-Epileptic and Sedative Effects of Dexmedetomidine. International Journal of Molecular Sciences. 2023. 24(11): 9445. DOI: 10.3390/ijms24119445 .
- Sitnikova E., Rutskova E., Smirnov K.Alpha2-Adrenergic Receptors as a Pharmacological Target for Spike-Wave Epilepsy. International Journal of Molecular Sciences. 2023. 24(2):1477. DOI: 10.3390/ijms24021477.
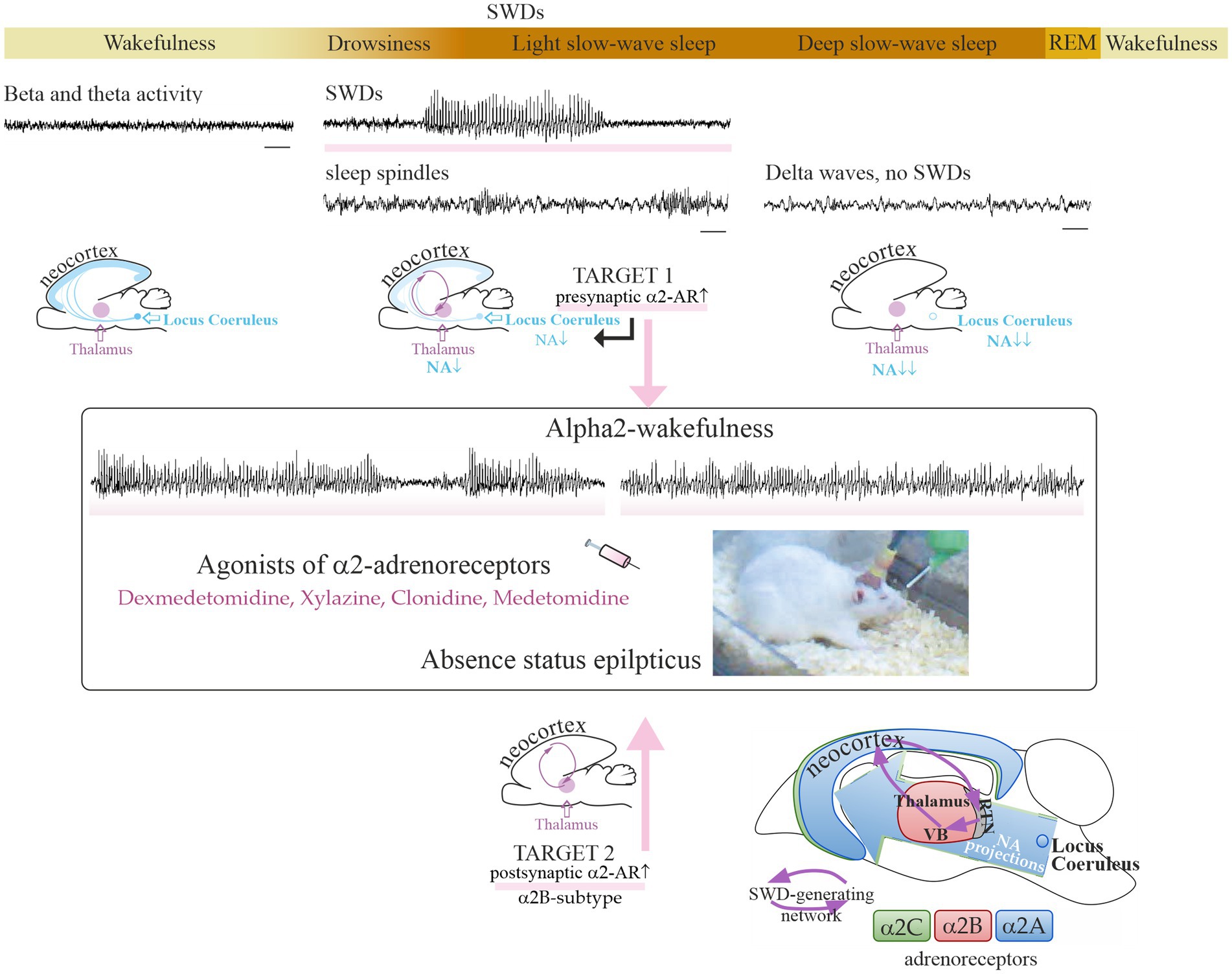
Использована иллюстрация [3] с разрешения авторов под лицензией CC BY 4.0. © 2023
-
Определена новая терапевтическая мишень для лечения редкого типа детской эпилепсии
Связанная с эпилепсией киназа CDKL5 фосфорилирует потенциалзависимый кальциевый канал Cav2.3, изменяя кинетику инактивации и возбудимость нейронов. Энцефалопатии развития и эпилептические энцефалопатии (ЭЭЭ) представляют собой группу редких детских расстройств, характеризующихся тяжелой эпилепсией и когнитивными нарушениями. Благодаря достижениям в области геномной диагностики были открыты многочисленные гены DEE, однако предполагаемые молекулярные связи между этими расстройствами неизвестны. Расстройство дефицита CDKL5 (CDD, DEE2), одна из наиболее распространенных генетических эпилепсий, вызвано мутациями, приводящими к потере функции киназы CDKL5, обогащенной мозгом. Чтобы выяснить функцию CDKL5, мы искали субстраты CDKL5, используя фосфопротеомный экран на основе SILAC. Мы идентифицировали потенциалзависимый Ca 2+ -канал Cav2.3 (кодируемый CACNA1E ) как физиологическую мишень CDKL5 у мышей и людей. Электрофизиология рекомбинантных каналов и междисциплинарная характеристика мышей с фосфомутантом Cav2.3 показали, что потеря фосфорилирования Cav2.3 приводит к усилению функции канала за счет более медленной инактивации и усиленной холинергической стимуляции, что приводит к повышенной возбудимости нейронов. Таким образом, наши результаты показывают, что CDD частично является каналопатией. Свойства нефосфорилированного Cav2.3 очень напоминают свойства, описанные для мутаций усиления функции CACNA1E , вызывающих DEE69, расстройство, имеющее общие клинические признаки с CDD. Мы показываем, что эти два моногенных заболевания механически связаны и могут быть улучшены с помощью ингибиторов Cav2.3.
-
Трансляционное исследование острой травмы головного мозга: высокая частота эпилептиформной активности на электрокортикограммах человека и крысы и гистологические корреляты у крыс
У людей ранняя патологическая активность на инвазивных электрокортикограммах (ЭКоГ) и ее предполагаемая связь с патоморфологией в раннем периоде черепно-мозговой травмы (ЧМТ) остаются неясными. Наши сотрудники из Лаборатории функциональной биохимии нервной системы оценивали патологическую активность на электроэнцефалограммах (ЭЭГ) и ЭКоГ у пациентов с острой ЧМТ, ранние электрофизиологические изменения после латеральной жидкостной перкуссионной травмы головного мозга (ППН) и электрофизиологические корреляты повреждения гиппокампа (микроглиоз и потеря нейронов) через неделю после ЧМТ. у крыс. Они установили, что эпилептиформная активность на ЭКоГ была очевидна у 86% пациентов в остром периоде ЧМТ, ЭКоГ были более чувствительны к эпилептиформным и периодическим разрядам. «Щеткообразный» рисунок ЭКоГ, наложенный на ритмическую дельта-активность и периодические выделения, был впервые описан при острой ЧМТ. У крыс FPI увеличивал частоту высокоамплитудных спайков в неокортексе и, что наиболее выражено, в ипсилатеральном гиппокампе, индуцировал гиппокампальный микроглиоз и потерю нейронов, причем ипсилатеральная зубчатая извилина была наиболее уязвимой через неделю после TBI. Частота возникновения эпилептиформных спайков коррелировала с плотностью микроглиальных клеток и потерей нейронов в ипсилатеральном гиппокампе. На основании этого они пришли к выводу, что эпилептиформная активность часто встречается в остром периоде ЧМТ и на микроскопическом уровне связана с отдаленным повреждением гиппокампа. Это повреждение, вероятно, связано с поздними последствиями ЧМТ. Модель FPI подходит для изучения патогенетических механизмов посттравматических расстройств.