Гиппокамп
-
Восстановление мозга: митохондрии являются ключом к нейрогенезу
Исследователи сделали революционное открытие о процессе созревания нейронов головного мозга, подчеркнув решающую роль слияния митохондрий в этих клетках. Их исследование показывает, что по мере развития нейронов их митохондрии претерпевают динамические изменения, которые имеют решающее значение для способности нейронов формировать и совершенствовать связи, поддерживая синаптическую пластичность во взрослом гиппокампе.
https://neurosciencenews.com/mitochondira-neurogenesis-neuropplasticity-25869/
-
Отсроченная гибель нейронов, вызванная ЧМТ, в ипсилатеральном гиппокампе и поведенческие дефициты у крыс: влияние кортикостерон-зависимой систематической ошибки выживаемости?
Острое и хроническое повышение кортикостерона (КС) после черепно-мозговой травмы (ЧМТ) может быть связано с отдаленным повреждением гиппокампа и развитием поздней посттравматической поведенческой патологии. CS-зависимые поведенческие и морфологические изменения изучали через 3 месяца после ЧМТ, вызванной боковой перкуссией жидкости, у 51 самца крысы Sprague-Dawley. ХС измеряли на фоне через 3 и 7 дней, а также через 1, 2 и 3 месяца после ЧМТ. Тесты, включая открытое поле, приподнятый крестообразный лабиринт, определение местоположения объекта, тесты на распознавание новых объектов (NORT) и лабиринт Барнса с обратным обучением, использовались для оценки поведенческих изменений в остром и позднем периодах ЧМТ. Повышение ХС на 3-е сутки после ЧМТ сопровождалось ранними CS-зависимыми объективными нарушениями памяти, выявленными при NORT. Уровни ХС в крови > 860 нмоль/л предсказывали отсроченную смертность с точностью 0,947. Через 3 мес после ЧМТ выявлены ипсилатеральная потеря нейронов в зубчатой извилине гиппокампа, микроглиоз в контрлатеральной зубчатой извилине и двустороннее истончение клеточных слоев гиппокампа, а также отсроченный дефицит пространственной памяти в лабиринте Барнса. Поскольку выжили только животные с умеренным, но не тяжелым посттравматическим подъемом CS, мы предполагаем, что умеренные поздние посттравматические морфологические и поведенческие нарушения могут быть, по крайней мере, частично замаскированы CS-зависимой ошибкой выживаемости.
-
Детальный анализ дорсально-вентральных градиентов экспрессии генов в гиппокампе взрослых крыс
Мы провели секвенирование РНК дорсальной и вентральной частей гиппокампа и сравнили его с ранее опубликованными данными, чтобы определить различия в дорсовентральных градиентах экспрессии генов, которые могут быть результатом биологической или технической изменчивости. Наши данные свидетельствуют о том, что дорсальная и вентральная части гиппокампа различаются по экспрессии генов, связанных с сигнальными путями, опосредованными классическими нейротрансмиттерами (глутамат, ГАМК, моноамины и др.), а также пептидами и лигандами Wnt. Эти части гиппокампа также расходятся по экспрессии молекул, направляющих аксоны (как рецепторов, так и лигандов), и изоформ сплайсинга генов, связанных с межклеточной передачей сигналов и клеточной адгезией. Более того, анализ дифференциальной экспрессии генов, специфичных для астроцитов, микроглии, олигодендроцитов и сосудистых клеток, позволяет предположить, что ненейрональные клетки также могут различаться по характеристикам между частями гиппокампа. Анализ экспрессии мобильных элементов показал, что истощение рибосомальной РНК сильно увеличивает представленность мобильных элементов в библиотеках РНК и помогает обнаружить слабое преобладание экспрессии этих элементов в вентральном гиппокампе. Наши данные выявили новые молекулярные измерения функциональных различий между дорсальным и вентральным гиппокампом и указывают на возможные каскады, которые могут быть вовлечены в продольную организацию гиппокампа.
-
События раннего возраста и созревание зубчатой извилины: последствия для нейронов и глиальных клеток
Зубчатая извилина (ЗГ), важная часть гиппокампа, играет значительную роль в обучении, памяти и эмоциональном поведении. Факторы, потенциально влияющие на нормальное развитие нейронов и глиальных клеток ДГ во время его созревания, могут оказывать долговременное влияние на функции мозга. Стресс в раннем возрасте может изменить созревание ГД и вызвать пожизненные изменения в его структуре и функционировании, лежащие в основе патологий головного мозга у взрослых. В этой статье всесторонне рассмотрено созревание нейронов и глиальных клеток (микроглии и астроцитов), а также влияние событий раннего возраста на процессы созревания в ДГ. Ранние постнатальные вмешательства, влияющие на ДГ, в конечном итоге приводят к изменению количества гранулярных нейронов в ДГ, эктопическому расположению нейронов и изменениям нейрогенеза у взрослых. Неблагоприятные события в раннем возрасте провоцируют провоспалительные изменения в глии гиппокампа на клеточном и молекулярном уровнях сразу после воздействия стресса. Позже клеточные изменения могут исчезнуть, хотя изменения в характере экспрессии генов сохраняются. Дополнительные стрессовые события в более позднем возрасте способствуют проявлению глиальных изменений и поведенческих нарушений. Изменения в созревании нейрональных и глиальных клеток, вызванные стрессом в раннем возрасте, взаимозависимы и влияют на развитие нейронных сетей, тем самым предрасполагая мозг к развитию когнитивных и психических расстройств.
-
Глюкокортикоид-опосредованные механизмы повреждения гиппокампа: вклад в субгранулярный нейрогенез
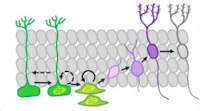
Сотрудники Лаборатории функциональной биохимии нервной системы представили исчерпывающий обзор взаимодействия между глюкокортикоидами (ГК) и нейрогенезом гиппокампа взрослых (AHN) в контексте больного мозга. Рассмотрены эффекторы ГК в нейрогенной нише зубчатой извилины гиппокампа и обсуждаются последствия передачи сигналов ГК на генерацию и интеграцию новых нейронов. Рассмотрены недавние открытия, демонстрирующие, как передача сигналов ГК опосредует нарушения AHN при различных патологиях головного мозга. ГК-опосредованные эффекты на генерацию и интеграцию взрослых нейронов в зубчатой извилине гиппокампа зависят от природы, тяжести и продолжительности действующего стрессового фактора. ГК реализуют свое влияние на АГН в первую очередь через специфические глюкокортикоидные и минералокортикоидные рецепторы. Нарушение реципрокной регуляции между осью гипоталамус-гипофиз-надпочечники (HPA) и генерацией зернистых нейронов, рожденных взрослыми, в настоящее время считается ключевым механизмом, вовлекающим AHN в патогенез многих заболеваний головного мозга, в том числе тех, которые не имеют прямого повреждение гиппокампа. Эти изменения варьируются от уменьшения пролиферации стволовых клеток и клеток-предшественников до повышенной гибели клеток и аномалий морфологии, связности и локализации молодых нейронов. Хотя участие взаимной регуляции между осью HPA и AHN в патогенезе когнитивных нарушений и нарушений настроения очевидно, отмечается несколько нерешенных критических вопросов. Понимание деталей ГК-опосредованных механизмов, вовлеченных в изменения в AHN, может позволить идентифицировать молекулярные мишени для улучшения вызванного патологией дисбаланса во взаимной регуляции оси HPA / AHN для преодоления когнитивных и психических нарушений.
-
Гиперглутаматергическая сигнализация в гиппокампе: раннее нацеливание на нейротрансмиссию глутамата как профилактическая стратегия при болезни Альцгеймера
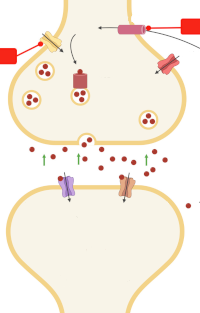
Сотрудники Лаборатории функциональной биохимии нервной системы осветили замечательное исследование в текущем выпуске Journal of Neurochemistry, в котором Хаскап и его коллеги предоставляют новые данные, показывающие, что рилузол, антиглутаматергический препарат, может быть многообещающей стратегией раннего вмешательства при болезни Альцгеймера (БА), направленной на восстановление нейротрансмиссия глутамата до накопления бляшек бета-амилоида (Aβ) и снижения когнитивных функций. Мыши APP / PS1, модель БА, изначально когнитивно нормальны, но имеют повышенное высвобождение глутамата в гиппокампе в возрасте 2–4 месяцев. Они начинают демонстрировать снижение когнитивных функций и накопление бляшек Aβ примерно в возрасте 6-8 месяцев, а также очевидную невропатологию БА и когнитивные нарушения в 10-12 месяцев. Лечение рилузолом в течение 4 месяцев (в возрасте 2–6 месяцев), направленное на ранние изменения глутаматергической нейротрансмиссии, предотвращает снижение когнитивных функций, наблюдаемое в возрасте 12 месяцев, и восстанавливает глутаматергическую нейротрансмиссию. Это одно из наиболее убедительных доклинических данных, подтверждающих идею нацеливания нейротрансмиссии глутамата у пациентов с риском БА и использования рилузола для этой цели.
-
Ca2+ -активированные калиевые каналы KCa3.1 способствуют медленной постгиперполяризации в пирамидных нейронах неокортекса L5
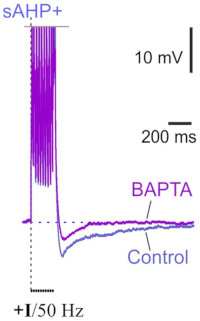
Известно, что пирамидные нейроны неокортикального слоя 5 демонстрируют медленную Ca2+ -зависимую постгиперполяризацию (sAHP) после всплесков спайков, аналогичную той, что происходит в клетках гиппокампа CA1. Однако механизмы sAHP в неокортексе остаются плохо изученными. Сотрудники Лаборатории клеточной нейробиологии обучения идентифицировали Ca2+ -зависимые калиевые каналы KCa3.1 как вкладчики в sAHP в ER81-положительных пирамидных нейронах неокортекса. Более того, проведённые ими эксперименты убедительно подтверждают, что взаимосвязь между sAHP и KCa3.1 каналами в механизме обратной связи лежит в основе адаптации частоты пиков пирамидных нейронов слоя 5. Исследователи продемонстрировали взаимосвязь между каналами KCa3.1 и sAHP с использованием нескольких параллельных методов: электрофизиологии, фармакологии, иммуногистохимии и фотоактивируемых зондов. Их эксперименты показали, что иммунофлуоресценция ER81 в слое 5 совместно локализована с иммунофлуоресценцией KCa3.1 в соме. Нацеленное раскрытие Ca2+ подтвердило две основные особенности каналов KCa3.1: предпочтительную соматодендритную локализацию и управляемое Ca2+ гейтирование. Кроме того, как sAHP, так и медленный гиперполяризующий ток, индуцированный Ca2+, были чувствительны к TRAM-34, селективному блокатору каналов KCa3.1.