Сенсорные системы
-
Пластичность ответных свойств нейронов зрительной коры мышей, вызванная оптогенетической тетанизацией in vivo
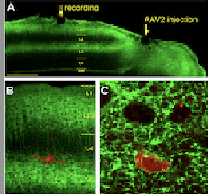
Первично сенсорные области неокортекса (зрительная, слуховая, соматосенсорная) у позвоночных представляют собой центральный отдел соответствующего сенсорного анализатора. Долгое время считалось, что во взрослом мозга эти области должны обеспечивать точное кодирование поступающей информации и поэтому не пластичны. Однако впоследствии было найдено, что существуют виды обучения, например, перцептивное обучение, которые сопровождаются пластическими перестройками в первичных сенсорных областях. Ярким примером такого обучения является способность различать близкие звуковые тоны, которая развивается при длительных занятиях музыкой. В опубликованной статье, сотрудники ИВНД и НФ РАН изучали клеточные механизмы пластичности первичной зрительной коры мыши. Принято считать, что основным механизмом синаптической пластичности является Хеббовская пластичность – когда пластическим модификациям подвергаются синапсы между нейронами, активность которых тем или иным способом синхронизована (firetogether –wiretogether). Однако помимо Хеббовской пластичности, существует еще значительно менее изученная гетеросинаптическая пластичность, которая заключается в модификации синапсов, вызванных исключительно активностью постсинаптического нейрона при неактивных пресинаптических входах. В нашей работе мы изучали изменение функциональных свойств (характеристики зрительных ответов) нейронов зрительной коры после индукции в них высокочастотных пачек потенциалов действия – внутриклеточной тетанизации. Ранее в многочисленных работах на срезах мозга было показано, что подобное воздействие приводит к массированным перестройкам синаптических входов на данный нейрон, выражающихся в том, что часть входов претерпевает долговрекменную потенциацию, а часть – долговременную депрессию. Для того, чтобы иметь возможность селективно активировать единичный нейрон в мозге мыши мы использовали метод оптогенетики – клетки были заражены адено-ассоциированным вирусом, несущим ген светоактивируемого белка канального родопсина 2. После этого к нейрону подводился тонкий стеклянный электрод, который, во-первых, позволял производить экстраклеточную регистрацию активности нейрона, а во-вторых, позволял локально освещать клетку синим светом, вызывая в ней высокочастотные пачки потенциалов действия. В начале эксперимента наркотизированной мыши с фиксированной головой на экране компьютера демонстрировались решетки, движущиеся в 12 различных ориентациях. Затем по ответам на каждый зрительный стимул строилась т.н. карта ориентационной селективности клеток. Нейроны в первичной зрительной коры отвечают не на все стимулы одинаково, но отвечают сильнее на стимул какой-то одной (оптимальной) ориентации и движущийся в оптимальном направлении. Чем больше разница между ответами на стимул, движущийся в оптимальном и не-оптимальном направлениях, тем более узко настроенной является клетка. Оказалось, что индукция высокочастотных (75-100Гц) пачек потенциалов действия в пирамидном нейроне зрительной коры приводит к тому, что его настройка становится более широкой. Таким образом, можно предположить, что высокочастотная спайковая активность, возникающая в зрительном корковом нейроне в отсутствии специфической сенсорной активации, например, во время сна, может приводить к снижению дирекциональной селективности клеток, что обеспечивает нейронам возможность более тонкой подстройки характеристик их зрительных ответов к новым зрительным сценам во время бодрствования. Возможно, что механизмом, лежащим в основе такой подстройки, является изменение эффективности синаптических входов, развивающиеся по механизму гетеросинаптической пластичности. Данное исследование было поддержано Российским научным фондом (грант № #20-15-00398).
-
Neuroscience and Behavioral Physiology

Журнал Neuroscience and Behavioral Physiology публикует оригинальные работы международного значения в области физиологии мозга, психофармакологии, нейроэндокринологии, нейрогенетики, психофизиологии и нейрохимии, а также анатомии и патологии нервной системы. В центре внимания журнала — фундаментальные исследования, связанные с функциями и поведением мозга, клеточными и молекулярными механизмами, лежащими в основе высших функций мозга.
-
Индуцированный слуховой ответ на частоте в 40 Гц как биомаркер генетического дефицита в гене SHANK3: клинический отчёт о 15-летней девочке с редким частичным дублированием гена SHANK3
SHANK3 кодирует каркасный белок, регулирующий плотность постсинаптических рецепторов в глутаматергических синапсах, в том числе в тормозных PV+-нейронах — ключевых игроках в образовании сенсорных гамма-колебаний, таких как слуховой индуцированный слуховой ответ на частоте 40 Гц (ASSR). Однако этот ответ не изучался в связи с функционированием SHANK3. Сотрудники лаборатории высшей нервной деятельности человека представили 15-летнюю девочку (SH01) с ранее не зарегистрированной дупликацией первых семи экзонов гена SHANK3 (22q13.33). Её электроэнцефалограммы, полученные во время серий щелчков частотой 40 Гц и длительностью 500 мс, бинаурально представленных с интервалами между пробами 500–800 мс, сравнивались с таковыми у типично развивающихся детей (n = 32). У этой девочки были диагностированы легкая умственная отсталость и неспособность к обучению (F70.88), дисграфия, дислексия и меньший словарный запас, чем у типично развивающихся (TD) сверстников. Ее клинический фенотип напоминал фенотип ранее описанных пациентов с микродупликациями 22q13.33 (на данный момент зарегистрировано около 30). Кроме того, у неё также были легкие симптомы аутизма, но ниже порога для диагностики РАС и микроцефалии. Никаких судорог или отклонений на МРТ не зарегистрировано. В то время как SH01 имела относительно сохраненный вызванный слуховой потенциал со слегка ослабленным компонентом P1, её ASSR на частоте 40 Гц полностью отсутствовала, что значительно отличалось от ASSR у контрольной группы. Подобное отсутствие у пациентов с микродупликацией, затрагивающей ген SHANK3, указывает на недостаточное временное разрешение слуховой системы, что может лежать в основе языковых проблем и представлять собой нейрофизиологический биомаркер аномалий SHANK3.